Medical Device Registration in Thailand
Authority for Medical Device
Thai FDA Medical Device Control Division is responsible for evaluating, assessing and monitoring medical devices to help Thais stay healthy and safe.
Medical Device Definition
Medical devices under the Medical Device Act, B.E. 2551 (2008) and its amendments, means:
1. Any instrument, apparatus, machine, implant, in vitro reagent that used inside or outside laboratory, material, software or related article intended by the manufacturer or product owner to be used in humans or animals, alone or combination for the specific purpose(s) of
(a) diagnosis, prevention, monitoring, treatment or alleviation of human or animal diseases
(b) diagnosis, monitoring, treatment of or compensation for an injury in human or animal
(c) investigation, replacement, modification, or support of the anatomy or of a physiological process in human or animal
(d) supporting or sustaining life of human or animal
(e) control of conception or aid in the reproduction of human or animal
(f) aiding or compensation for the disability of human or animal
(g) providing information for medical diagnostic purposes by means of
in vitro examination of specimens derived from human or animal
(h) disinfection of medical devices
Achievement of the purposes according to (1) in or on human or animal bodies must not intend by pharmacological, immunological or metabolic means.
2. Accessories pursuant to (1)
“Accessory” means the article, apparatus or product that is intended specially by its manufacturer or product owner to be used together with a particular medical device to enable or assist that device to be used in accordance with its intended purpose
3. Instruments, apparatus, machines, products or other articles declared by the Minister as medical device such as Alcohol Pad, Breath-alcohol Test, Methamphetamine Diagnostic Test Device
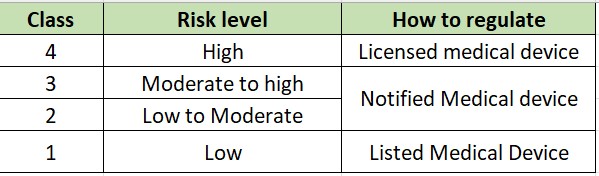
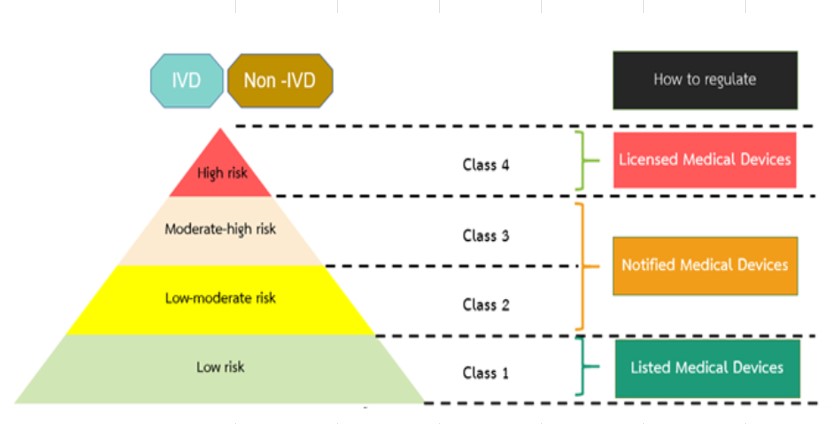
Medical Device Classification
An establishment registrant who would like to register a medical device in Thailand must first classify the risk of the medical device. Registration requirements will differ depending on the devices’ risk classification as the table below.
Medical Device Registration Pathways:
Now, there are 3 pathways for medical device registration in Thailand:
- Full evaluation => now THFDA allows “manufacturer or importer” to submit dossiers (for Class 2 – 4 Medical devices) either Partial or Full CSDT. However, 14 February 2024 will be the last day for Partial submission and Full CSDT submission will start on 15 February 2024 onwards.
- Concise pathway => aims to expedite the registration process and reduce evaluation fees (for class 2 – 4 medical devices)
- Reliance program => aims to expedite the registration process and reduce evaluation fees (for class 2 – 4 medical devices)

Document Requirements
MD Class 1
| No. | Document | Importer | Manufacturer | |
| 1 | Device Labelling according to labelling requirements for medica device in Thailand | Required | Required | |
| 2 | Leaflet/package insert/Instruction for Use according to labelling requirements for medica device in Thailand | Optional | Optional | |
| 3 | Product Specification | Required | Required | |
| 4 | Device Description and Features | Required | Required | |
| 5 | Material (Details and properties of materials used to produce or be components of medical devices) | Required | Required | |
| 6 | Declaration of conformity (template as required by Thai FDA) | Required | Required | |
| 7 | Letter of authorization (template as required by Thai FDA) | Required | – | |
| 8 | List of regulatory approval or marketing clearance (In the case of registration in a foreign country) | Optional | Optional | |
| 9 | Document showing sterility testing (for a sterile medical device) | Optional | Optional | |
| 10 |
| Optional | Optional | |
| 11 | เอกสารแสดงรายการเครื่องมือแพทย์ที่รวมกลุ่มและชี้แจ้งเหตุผล ของการรวมกลุ่มเครื่องมือแพทย์ ==> Document showing a list of grouped medical devices and explain the reasons for grouping medical devices (if applicable) | Optional | Optional | |
| 12 | **ผลการทดสอบตามมาตรฐานตามประกาศฯ เป็นการเฉพาะ (กรณีคมพ. เป็นเครื่องมือแพทย์ที่มีการควบคุมเป็นการเฉพาะ) ==> Test results of the testing (for specially controlled medical devices) | Required | Required | |
| 13 | Further information | Optional | Optional |
MD Class 2 3 4
| No. | Submission Dossier | Partial CSDT | Full CSDT |
| 1 | ฉลากเครื่องมือแพทย์ (Device Labelling) ตามประกาศฯ ฉลากและเอกสารกำกับเครื่องมือแพทย์ ==> Device Labelling | / | / |
| 2 | เอกสารกำกับเครื่องมือแพทย์ ตามประกาศฯ ฉลากและเอกสารกำกับเครื่องมือแพทย์ ==> Leaflet/package insert/Instruction for Use | / | / |
| 3 | บทสรุปเกี่ยวกับเครื่องมือแพทย์ โดยต้องมีรายละเอียดดังนี้ ==> Executive summary (1) อธิบายสรุปภาพรวมของเครื่องมือแพทย์ ==> overview (2) ตารางแสดงประวัติการได้รับอนุมัติการขึ้นทะเบียนหรืออนุญาตให้วางจำหน่ายในท้องตลาดและประวัติการจำหน่ายในประเทศต่างๆ ==> History of marketing & marketing authorization in other countries, esp. reference countries: USA, EU, Canada, Australia and Japan, with their valid licenses (3) ตารางแสดงรายละเอียดของการถูกเพิกถอน (ถ้ามี) ==> Withdrawal (iif applicable) (4) ตารางแสดงสถานภาพของคำขอขึ้นทะเบียนหรืออนุญาตเพื่อวางจำหน่ายผลิตภัณฑ์ในตลาดที่ยังค้างอยู่หรืออยู่ในระหว่างดำเนินการ (ถ้ามี) ==> Registration status in other countries, e.g. during submission for approval, pending, rejection, etc. (5) ตารางแสดงรายงานเหตุการณ์อันไม่พึงประสงค์จากการใช้เครื่องมือแพทย์ให้แนบเอกสารระบุรายละเอียดของ AE ==> Important safety/performance related information (6) ตารางแสดงรายงาน field safety corrective action (FSCAs) ให้แนบเอกสารระบุรายละเอียดของรายงาน FSCAs ==> field safety corrective action (FSCAs), evident is required (7) ให้แสดงรายละเอียดของเครื่องมือแพทย์ ในกรณีดังต่อไปนี้ มีเซลล์ เนื้อเยื่อหรืออนุพันธ์ของมนุษยหรือสัตว์ที่ถูกทำให้ไม่มีชีวิต (rendered non-viable) ,มีเซลล์ เนื้อเยื่อ หรืออนุพันธ์ของจุลินทรีย์(microbial) หรือจุลินทรีย์ตัดแต่งพันธุกรรม (recombinant origin) ,มีส่วนประกอบที่ปล่อยรังสี(irradiating component) ชนิดแตกตัวเป็นอิออน ==> Indicate material that from source of animal, human, microbial or recombinant origin, rendered non-viable, irradiating component | / | / |
| 4 | รายละเอียดเครื่องมือแพทย์ โดยต้องมีรายละเอียดดังนี้ ==> Device Description (1) ลักษณะทั่วไป และหลักการทำงาน ==> General description & principle (2) วัตถุประสงค์การใช้ ==> Intended use (3) ข้อบ่งใช้ ==> Indications (4) คำแนะนำการใช้ ==> Instructions for use (5) การเก็บรักษา ==> Storage condition (6) อายุการใช้ ==> Shelf life report (7) ข้อห้ามใช้ ==> Contraindications (8) คำเตือน ==> Warnings (9) ข้อควรระวัง ==> Precautions (10) ผลอันไม่พึงประสงค์จากการใช้ ==> Potential adverse effects (11) การรักษาด้วยทางเลือกอื่น ==> Alternative therapy (12) รายละเอียดและสมบัติของวัสดุที่ใช้ผลิตหรือเป็นส่วนประกอบของเครื่องมือแพทย์ ==> Materials and properties of product (13) ข้อกำหนดเฉพาะของเครื่องมือแพทย์ (product specifications) | / | / |
| 5 | Essential Principle | x | / |
| 6 | Summary Verification & validation | x | / |
| 7 | เอกสารแสดงการวิเคราะห์ความเสี่ยง (Risk analysis) | / (Class 4 only) | / |
| 8 | เอกสารแสดงชื่อและที่ตั้งของสถานที่ผลิตเครื่องมือแพทย์ และข้อมูลการผลิตเครื่องมือแพทย์หรือรายละเอียดเจ้าของผลิตภัณฑ์ ==> manafactuerer information, Manufacturing site name & address, Manufacturing process flow-chart and explanation each step, including equipment for manufacturing & control, environment or manufacturing condition | / | / |
| 9 | เอกสารแสดงวิธีการทำลาย การทำให้สิ้นสภาพ หรือการขจัดของเสียที่เกิดขึ้นภายหลังการใช้ (ถ้ามี) ==> Destruction method information (if applicable) | / | / |
| 10 | หนังสือรับรองระบบคุณภาพการผลิต ISO/GMP ==> GMP or quality system certificate, GMP/ISO Certification of the physical manufacturing site | / | / |
| 11 | หนังสือรับรองวัตถุประสงค์การใช้ ข้อบ่งใช้ การบรรจุ หนังสือรับรองฉลากและวิธีการใช้งานของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ ==> certificate of Intended use, indications, packing, Certificate of label and instructions for use of the manufacturer or product owner | x | / |
| 12 | Declaration of conformity | / | / |
| 13 | หนังสือรับรองแสดงประวัติการจำหน่าย คมพ. ของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ ==> certificate of free sale of manufacturer or product owner | x | / |
| 14 | หนังสือรับรองแสดงความปลอดภัยของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ ==> safety certificate of manufacturer or product owner | x | / |
| 15 | หลักฐานการอนุญาตจากหน่วยงานที่มีหน้าที่และอำนาจกำกับดูแลคมพ.ในต่างประเทศทอย.รับรอง ==> certificate of registration in other countries, issued by Health Authority | x | / |
| 16 | Letter of authorization (กรณีนำเข้า) ==> In case of import | / | / |
| 17 | เอกสารแสดงรายการเครื่องมือแพทย์ที่รวมกลุ่ม และชี้แจงเหตุผลของการรวมกลุ่มเครื่องมือแพทย์ (ถ้ามี) ==> Document showing a list of grouped medical devices and clarify the reasons for grouping medical devices (if applicable) | / | / |



